Stärke ist nicht gleich Stärke – ein Blick ins Innerste eines Gerstenkorns
Braugerste | Veränderte Klimabedingungen während der Kornfüllungsphase können zu spürbaren Qualitätseinbußen bei der Braugerste führen. Der Artikel analysiert, wie sich Wuchsstandort und Witterung auf den Stärkeaufbau im Gerstenkorn auswirken.
Die beiden Extrem-Jahrgänge 2018 und 2019 führten in der deutschen Brauwirtschaft teilweise zu spürbaren Qualitätseinbußen hinsichtlich des Verzuckerungserfolges der Malzstärke im Sudhaus. Trotz in der Regel guter enzymatischer Ausstattung kam es zu Ausbeuteverlusten, niedrigen Endvergärungsgraden und verlängerten Verzuckerungszeiten, die die Bierqualität spürbar negativ beeinflussten. Vermutlich resultierten die extremen Klimabedingungen während der Kornfüllungsphase in einer Veränderung der Stärkestruktur.
Um den Ursachen hierfür auf den Grund zu gehen, ist ein Blick tief ins Gerstenkorn hinein notwendig: Wie ist der Stand der Wissenschaft bezüglich des Aufbaus der Stärke? Weshalb haben der Wuchsstandort und die dort herrschende Witterung eine so große Bedeutung für die resultierende Stärkestruktur? Und: Wie läuft die Synthese der Stärke während des Pflanzenwachstums eigentlich ab?
Relevanz der Stärke für die Braubranche
Die Stärke der Gerste nimmt eine zentrale Rolle in der gesamten Malz- und Bierbereitung ein. Umso verwunderlicher ist es, dass die Stärke und deren Beschaffenheit in den vergangenen Jahren verhältnismäßig wenig Aufmerksamkeit bekam: Alternative Hefen und vor allem die Hopfentechnologie standen im Fokus der Forschungsaktivitäten.
Dabei ist die Stärke – mit ca. 65 Prozent der Hauptbestandteil des Gerstenkornes – in vielerlei Hinsicht maßgeblich von Relevanz: Ihre Beschaffenheit beeinflusst nicht nur die Restsüße, die Vollmundigkeit und den Körper eines Bieres, sondern letztendlich entscheidet der Anteil an vergärbaren Zuckern auch, wie viel Alkohol es nach der Fermentation enthalten wird. Darüber hinaus ist Stärke aus wirtschaftlicher Sicht zu berücksichtigen, da sie einen wesentlichen Einfluss auf die Rohstoffausbeute sowie die Maisch-, Läuter- und Filtrationszeiten ausübt.
Dass der Stärke in den vergangenen Jahren in Forschung- und Qualitätskontrolle verhältnismäßig wenig Aufmerksamkeit zu Teil wurde, ist vermutlich dem geschuldet, dass ihr Anteil im Korn züchterisch bereits optimiert wurde und sie – glücklicherweise – kaum Verarbeitungsprobleme verursacht hat. Bereits in den Erntejahrgängen 2006 und 2012, deren Sommer außergewöhnlich heiß und trocken waren, traten vereinzelt Verzuckerungsprobleme und/oder Ausbeuteverluste auf.
Solche Jahre waren jedoch rückblickend eher die Ausnahme. Dann kam der „Hitzesommer“ 2018, worauf ein ähnlich heißes Jahr 2019 folgte, in dem die Böden gleichzeitig mit dem existierenden Wasserdefizit des Vorjahres zu kämpfen hatten. Bedingungen also, die sich anscheinend auch auf die Synthese der Stärke auswirkten und vermehrt zu Problemen in diversen Betrieben führte.
Stärkeaufbau im Detail
Reine Stärke besteht aus einer „Verknüpfung“ zahlreicher Glucose-Moleküle, die α-glycosidisch aneinander gebunden sind. Hierbei wird in Abhängigkeit der Bindungsstelle zwischen den sich ergebenden Molekülen der Amylose (AM) und des Amylopektin (AP) unterschieden. AM macht ca. 20 – 30 Prozent der Gesamtstärke aus und liegt, bedingt durch die überwiegend lineare Bindungsart α(1 → 4), in einer helikalen Schraubenform vor. AP ist mit 70 – 80 Prozent der Hauptbestandteil pflanzlicher Stärke und liegt aufgrund der zusätzlichen α(1 → 6) Bindungen in verzweigter Form vor, wobei sich die Seitenketten in Länge und Verzweigungsgrad unterscheiden.
Die detaillierte Organisation dieser beiden Moleküle ist seit Jahrzehnten Gegenstand intensiver polymerchemischer Forschung, sodass heute das Grundprinzip des Aufbaus gut verstanden ist: AM und AP lagern sich zusammen und bilden Stärkekörner unterschiedlicher Größe (Durchmesser ca. 2 – 40 µm).
Blickt man ins Innere eines solchen Stärkekornes, ist ein schichtweiser Aufbau ersichtlich, der sich in alternierende harte (kristalline) und weiche (amorphe) Ebenen gliedert.
Vor allem die großen AP-Moleküle (zur Verdeutlichung vgl. Abb. 1) sind maßgeblich strukturgebend. Denn ihre Seitenketten (B- und A-Ketten) bilden analog zur AM Helices, die sich in Clustern um die Hauptkette (C-Kette) zusammenlagern. Durch die Länge der Helices und die Anzahl der beteiligten Seitenketten ergibt sich aufgrund der Vielzahl an Wasserstoffbrücken-Bindungen zwischen den einzelnen Ketten die feste (kristalline) Schicht.
Dort, wo sich hingegen die Querverzweigungen von den Haupt- und Nebenketten (C- und B-Ketten) ansammeln, resultiert eine weichere (amorphere) Schicht (vgl. Abb. 1). Die langen, weitestgehend unverzweigten AM-Ketten lagern sich nun überwiegend in diesen amorphen Schichten und zwischen den einzelnen AP-Clustern ein.
Über die Festigkeit eines solchen Stärkekornes entscheidet nun maßgeblich die Anordnung der AP-Seitenketten (A-type, B-type allomorph), deren Länge, die Anzahl in einem beteiligten Cluster innerhalb der harten Lamelle und die Anzahl und Anordnung der Verzweigungsstellen innerhalb der weicheren Lamelle. Angesichts der Vielzahl an Stärkekörnern und deren unterschiedlich verteilter Größe, welche auf jeweils unterschiedlichen inneren Aufbau hinweist, wird die Komplexität der Aufklärung der exakten Struktur deutlich.
Die Struktur der Stärke hat dabei in zweierlei Hinsicht einen bedeutenden Einfluss auf das Verzuckerungsverhalten beim Maischprozess. Zum einen ist sie dafür verantwortlich, wie fest und kompakt die einzelnen Stärkekörner sind, was wiederum über die Höhe der Verkleisterungstemperatur (VKT) entscheidet. Die VKT ist diejenige Temperatur, bei der ein Stärkekorn beim Maischen zu quellen beginnt, seine kristalline Struktur verliert und dadurch von amylolytischen Enzymen schnell und effektiv abgebaut werden kann. Die VKT bewegt sich bei Gerstenstärke in der Regel zwischen 58 und 64 °C.
Zum anderen entscheidet die Struktur der Stärke vor allem durch die Anzahl und Verteilung der α(1 → 6)-Bindungen im AP schon darüber, wie viele unvergärbare Zucker nach dem Maischen in der Würze selbst bei optimaler Verkleisterung und Enzymaktivität verbleiben werden.
Doch aus welchem Grund gibt es nun auch innerhalb derselben Gerstensorte deutlich messbare jahrgangsbedingte Veränderungen der Stärkestruktur? Um das verständlich aufzeigen zu können, ist es im Vorfeld von Vorteil, einen Einblick in die Synthese der Gerstenstärke beim Pflanzenwachstum zu gewinnen.
Synthese der Stärke beim Wachstum der Gerste
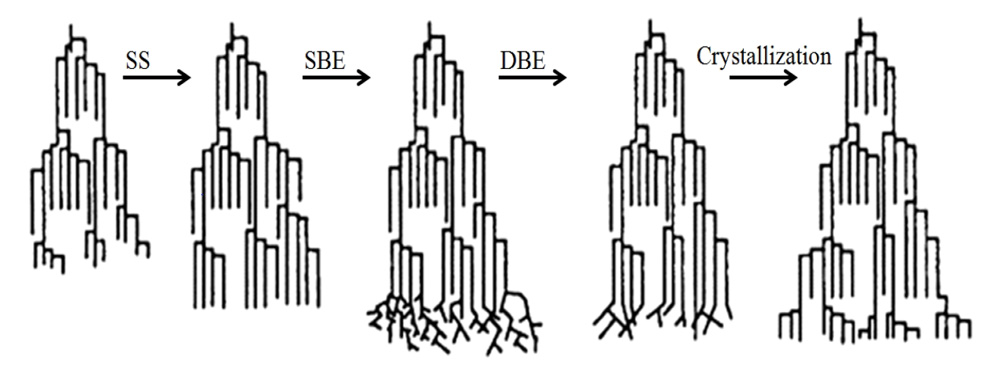
Im Zentrum der hier betrachteten Speicherstärke im Endosperm steht die ADP-Glucose, welche in einem separaten Syntheseweg aus von den Blättern stammender Saccharose resultiert und mittels eines Transportproteins in die Amyloplasten gebracht wird. Dort steht sie als Kohlenstoffquelle für die Synthese der AM und des AP zur Verfügung. Drei Enzym-Gruppen greifen im Rahmen der Stärkesynthese nun auf die ADP-Glucose zurück: die Stärke-Synthasen (SS), die Stärkeverzweigungsenzyme (SBE, von engl. „starch branching enzymes“) sowie die verzweigungsabbauenden Enzyme (DBE, von engl. „debranching enzymes“).
A) Stärkesynthasen (SS)
Zwei Untergruppen lassen sich aus den SS ableiten: lösliche Stärkesynthasen (SSI bis SSIV), welche frei im Stroma vorkommen und nachweislich nur an der Synthese von AP beteiligt sind, und (an Stärkekörner) gebundene SS (GBSSI, von engl. „granule bond starch synthases“), welche im Wesentlichen für die Synthese von AM zuständig sind, aber vermutlich auch eine Rolle bei der AP-Synthese spielen. Der AM-Gehalt einer Gerste ist nachweislich abhängig von der Aktivität der GBSSI [10]. Die GBSSI sind immobil und synthetisieren lange AM-Ketten bis zu einem Polymerisationsgrad (DP) von 6000.
Bei den löslichen Stärkesynthasen verlängert SSI kurze α-Glucan-Ketten mit einem DP von 6 – 7 zu Ketten mit einem DP von 8 – 12. Die Produkte von SSI sind ideale Substrate für SSII, welches α-Glucan-Ketten mit einem DP von 12 – 24 bildet [13]. SSIII hingegen ist beteiligt an der Synthese von langen α-Glucan-Ketten (DP 25 – 35 und größer), welche häufig eine Verbindung von einzelnen AP-Clustern darstellen. SSIV stellt die jüngst entdeckte lösliche SS dar: Sie ist phylogenetisch ähnlich zu SSIII, sehr reaktiv auf Maltotriose und vermutlich an der Kontrolle der Anzahl von Stärkekörnern pro Plastid beteiligt [9].
B) Stärkeverzweigungsenzyme (SBE)
Die SBE katalysieren die Hydrolyse einer vorhandenen α-1,4-Glucan-Kette mit anschließender Übertragung des gespaltenen Teils der Glucankette mit sechs oder mehr Glucoseeinheiten auf den C6-Teil derselben Glucankette (Intra-Chain-Transfer) oder einer angrenzenden Glucan-Kette (Inter-Chain-Transfer) über eine α-1,6-Bindung. Sie haben damit eine grundlegende Funktion bei der Bildung von verzweigtem AP [3]. Zwei Klassen von SBE (SBE1 und SBE2), die sich hinsichtlich ihrer Substratspezifität unterscheiden, konnten hierbei nachgewiesen werden.
C) Verzweigungsabbauende Enzyme (DBE)
Die DBE haben nun eine entscheidende Rolle bei der Bildung der kristallinen Struktur von AP. Sie trennen ausgewählte, vorhergehend von SBE verknüpfte α-1,6-Bindungen, um eine geordnete Verzweigungsstruktur mit ausreichenden parallelen linearen Anteilen innerhalb eines AP-Moleküls zu ermöglichen [1]. Das Schema in Abbildung 2 veranschaulicht diese für die Kristallinität von AP maßgebliche regulierende Eigenschaft der DBE.
Einfluss der Witterungsbedingungen auf die Stärkesynthese
Abiotischer Stress während des Pflanzenwachstums, insbesondere Trockenheit und Hitze, haben einen bedeutenden Einfluss auf die einzelnen Stärkesynthese-Wege: Gegenüber Trockenheit sind die GBSII sowie vor allem die löslichen SS empfindlich: Ihre Aktivität nimmt bei akutem Wassermangel rapide ab, bleibt aber auch über längere Trockenheitsphasen auf einem niedrigen, aber konstanten Niveau. Zusätzlich konnte eine Aktivitätsminderung der AGPase, UGPase sowie der Saccharose-Synthase gefunden werden, die allesamt für die Synthese der ADP-Glucose wichtig sind. Unter Trockenheit kommt es demnach zu einer Unterversorgung an ADP-Glucose, welche in einen reduzierten AM-Gehalt münden kann, da die GBSII im Vergleich zu den löslichen SS eine geringere Affinität zu ADP-Glucose aufweist und demnach auch bei einem Mangel an ADP-Glucose vermehrt die löslichen SS auf ADP-Glucose zurückgreifen.
Untersuchungen zum Einfluss der Trockenheit auf die Stärkekorngrößen zeigen, dass sowohl die A- als auch die B-Körner im Vergleich zu Kontrollgruppen verkleinert ausfallen. Während dies bei Weizen einheitlich für alle Korngrößenklassen festgestellt werden konnte, bewirkte der Wassermangel bei Gerste überwiegend eine Verkleinerung der B-Korn-Fraktion [2].
Eine Konfrontation der Pflanzen mit Hitze in einem frühen Entwicklungsstadium kann bei Gerste im Extremfall zu einer irreversiblen Denaturierung der für die ADP-Glucose wichtigen Saccharose-Synthase führen [6]. Zudem sind vor allem die löslichen SS hitzeanfällig, da für sie über Temperaturen von 35 °C nahezu keine Aktivität mehr festgestellt werden kann. Ähnliches gilt in weniger ausgeprägter Form auch für die GBSII. Dies kann in einer Zunahme kurzer Kettenenden innerhalb der AP-Clusters sowie einem Anstieg des AM-Gehalts münden [4]. Darüber hinaus konnte auch eine Hitzeinstabilität der SBE festgestellt werden, mit der eine durch Hitze ausgelöste signifikante Veränderung der Kettenlängenverteilung von AP bei Versuchen mit Reis begründet wird [7].
Zusammenfassung und Ausblick
Die Synthese der Stärke ist ein hochkomplexes Zusammenspiel zahlreicher Enzyme, deren Aktivitäten von mehreren Umweltfaktoren abhängen. Die innere Struktur von Stärken kann selbst bei gleicher Pflanzengenetik aufgrund der unterschiedlichen Witterungsbedingungen standortabhängig stark variieren. Eine schwankende Zuckerzusammensetzung der Bierwürze je nach enzymatischer Umsetzung der Stärke ist die resultierende Folge für die Brauwirtschaft. Auch wenn die Wissenschaft hier noch relativ am Anfang steht, konnten vor allem die Wetterextreme Hitze und Trockenheit (v. a. während der Kornfüllungsphase) als gravierende Einflussfaktoren auf die Stärkesynthese charakterisiert werden. Dies ist im Hinblick auf den Klimawandel, der eine zunehmende Häufung dieser Wetterextreme in Europa erwarten lässt, bedenklich. Diese Herausforderungen erfordern eine detailliertere Aufklärung der zugrundeliegenden Mechanismen der Stärkesynthese und langfristige z. B. züchterische Lösungsstrategien.
Sie wollen mehr zum Thema wissen? Dann werfen Sie doch mal einen Blick in unser Dossier: Malz und Maischen.
Literatur
- Ball, S.; Guan, H.-P.; James, M.; Myers, A.; Keeling, P.; Mouille, G.; Buléon, A.; Colonna, P.; Preiss, J.: „From glycogen to amylopectin: a model for the biogenesis of the plant starch granule”, Cell 1996, 86, S. 349-352, DOI: 10.1016/S0092-8674(00)80107-5.
- Brooks, A.; Jenner, C. F.; Aspinall, D.: „Effects of water deficit on endosperm starch granules and on grain physiology of wheat and barley”, Functional Plant Biol. 1982, 9, S. 423-436, DOI: 10.1071/PP9820423.
- Drummond, G. S.; Smith E. E.; Whelan, W. J.: „Purification and Properties of Potato”, European journal of biochemistry 1972, 26, S. 168-176, DOI: 10.1111/j.1432-1033.1972.tb01753.x.
- Hurkman, W. J.; McCue, K. F.; Altenbach, S. B.; Korn, A.; Tanaka, C. K.; Kothari, K. M.; Johnson, E. L.; Bechtel, D. B.; Wilson, J. D.; Anderson, O. D.; DuPont, F. M.: „Effect of temperature on expression of genes encoding enzymes for starch biosynthesis in developing wheat endosperm”, Plant Science 2003, 164, S. 873-881, DOI: 10.1016/S0168-9452(03)00076-1.
- Imberty, A.; Pérez, S.: „Conformational analysis and molecular modelling of the branching point of amylopectin”, International Journal of Biological Macromolecules 1989, 11, S. 177-185, DOI: 10.1016/0141-8130(89)90065-2.
- MacLeod, L. C.; Duffus, C. M.: „Reduced Starch Content and Sucrose Synthase Activity in Developing Endosperm of Barley Plants Grown at Elevated Temperatures”, Functional Plant Biol. 1988, 15, S. 367-375, DOI: 10.1071/PP9880367.
- Ohdan, T.; Sawada, T.; Nakamura, Y.: „Effects of Temperature on Starch Branching Enzyme Properties of Rice”, J. Appl. Glycosci. 2010, 58, S.19-26, DOI: 10.5458/jag.jag.JAG-2010_014.
- Patterson, J. A.; Emes, M. J.; Tetlow, I. J.: o.T., Encyclopedia of Applied Plant Sciences, Elsevier, 2017, S. 570-576.
- Raynaud, S.; Ragel, P.; Rojas, T; Mérida, Á.: „The N-terminal Part of Arabidopsis thaliana Starch Synthase 4 Determines the Localization and Activity of the Enzyme”, The Journal of biological chemistry 2016, 291, S. 10759-10771, DOI: 10.1074/jbc.M115.698332.
- Seung, D.; Soyk, S. Coiro, M.; Maier, B.A.; Eicke, S.; Zeeman, S.C.: „Protein Targeting To Starch Is Required For Localising Granule-Bound-Starch Synthase To Starch Granules And For Normal Amylose Synthesis In Arabidopsis”, PLoS biology 2015, 13, e1002080, DOI: 10.1371/journal.pbio.1002080.
- Wang, K.; Henry, R. J.; Gilbert, R. G.: „Causal Relations Among Starch Biosynthesis, Structure, and Properties”, Springer Science Reviews 2014, 2, S.15-33, DOI: 10.1007/s40362-014-0016-0.
- Ahmed, Z.: The Regulation of Starch Biosynthesis in Barley (Hordeum vulgare), University of Guelph, Guelph, Ontario, Canada, 2014.
- Zhang, X.; Colleoni, C.; Ratushna, V.; Sirghie-Colleoni, M.; James, M. G.; Myers, A. M.: „Molecular characterization demonstrates that the Zea mays gene sugary2 codes for the starch synthase isoform SSIIa”, Plant molecular biology 2004, 54, S. 865-879, DOI: 10.1007/s11103-004-0312-1.
Schlagworte
Autoren
Martina Gastl, Thomas Becker, Stefan Hör
Quelle
BRAUWELT 1-2, 2021, S. 8-10
Firmen
- Technische Universität München (TUM), München, Deutschland


![Schematische Darstellung zweier AP-Moleküle nach Imberty et al. [5]](/images/artikelbilder/2021/Januar/BW1-2/brauwelt-abb1-amylopektin-2021.jpg)